文章来源:
《中国肿瘤》 2019 年第 28 卷第 6 期
China Cancer,2019,Vol.28,No.6
作者:
曾珍1 ,杜驰2 ,涂梨1 ,王力1 ,王喻义 1 ,罗锋1( 1. 四川大学华西医院,生物治疗国家重点实验室,四川 成都 610041 ;2. 内江市第二人民医院,四川 内江 641000 )
乳腺癌是最常见的女性恶性肿瘤 [ 1 ] ,在女性人群中发病比例不断攀升,严重影响女性健康。乳腺癌生物学特性基本由雌激素受体( estrogen receptor , ER )、人表皮生长因子受体 2 ( human epidermal growth factor receptor 2 , HER-2 ) 和 细 胞 增 殖 抗 原 ( antigen KI67 , ki67 )决定。因此 ER 和 HER-2 的靶向治疗和化疗是乳腺癌最重要的内科治疗手段 [ 2 ] 。三阴性乳腺癌( triple negative breast cancer , TNBC )是一类缺乏雌激素受体( ER )、孕激素受体( progesterone receptor , PR ),以及人类表皮生长因子 2 ( HER-2 )表达的乳腺癌亚型, 它的发病率占乳腺癌总体发病率的 15%~20% [ 3 ] 。此类患者的复发和死亡风险明显高于其他类别。由于缺乏有效靶点,三阴乳腺癌的主要治疗方式是化学药物治疗, 含蒽环类和紫杉类是其标准治疗方案 [ 4 ] 。因此,提高三阴乳腺癌患者对化疗的耐受、 改善患者的生存质量与治疗疗效及患者的预后息息相关。
众所周知, 恶性肿瘤患者的营养状态与治疗的副作用、 并发症以及疾病预后密切相关。近期文献报道显示,营养免疫状态降低可作为胰腺癌、胃肠道肿瘤和肝癌的不良预后指标 [ 5 , 6 ] 。在三阴性乳腺癌患者中,营养免疫状态也可影响患者的长期预后 [ 7 ] 。这些研究都证明了营养状态是决定患者生存质量的重要指标 [ 8 ] 。营养不良是恶性肿瘤患者常见的并发症之一,严重营养不良导致恶液质的发生 [ 9 ] ,影响患者的治疗耐受、 生存质量以及预后。活性乳清蛋白—ABD 活性因子是一种从牛奶中低温萃取提取,具有多种活性成分的优质蛋白, 它可以促进抗氧化剂谷胱甘肽( GSH )的生物合成 [ 10 ] ,具有营养支持和调节免疫的作用。已有研究证实, 在胰腺癌荷瘤小鼠模型中,ABD 活性因子可以纠正其营养不良、改善恶病质 [ 11 ] 。但是,尚无研究报道 ABD 活性因子改善三阴性乳腺癌荷瘤小鼠的化疗耐受、生存质量、疗效及预后。本研究从化疗疗效、生存质量及生存期的角度证明活性乳清蛋白对三阴性乳腺癌荷瘤小鼠预后的改善作用。
1
材料与方法
1.1 主要试剂
DMEM 高糖培养基( Gibco ),胎牛血清( Thermo Fisher Scientific ),细胞培养用青—链霉素(碧云天),胰蛋白酶( Gibco ), ABD 活性因子(美睿健康产业重庆有限公司), 酪氨酸 (美睿健康产业重庆有限公司),紫杉醇注射液(扬子江药业集团有限公司),氯化钠注射液(四川美大康华有限公司),谷胱甘肽检测试剂盒(碧云天)。
1.2 仪 器
CO 2 恒温培养箱( SANYO ),超净工作台(苏州安泰空气技术公司),细胞计数板(上海求精生化仪器试剂公司),离心机( Eppendorf ),酶标仪( BIO-RAD ),天平(上海越平科学仪器制造有限公司),游标卡尺(上海浦江分析仪器厂),动物实验器材(成都科华实验仪器有限公司),小鼠饲养和动物实验设备(四川大学生物治疗国家重点实验室基因工程小鼠中心)。
1.3 细胞株
鼠源性 4T1 乳腺癌细胞株(中国科学院上海细胞生物研究所,本实验室常规保存备用)。
1.4 实验动物
4~6 周龄 SPF 级雌性 BALB/c 小鼠,购于四川大学实验动物中心。小鼠相关实验获得四川大学华西医院实验医学伦理委员会批准(编号 2011-020 )。
1.5 细胞培养
4T1 细胞使用 10% 胎牛血清和 100U/ml 青—链霉素的 DMEM 高糖培养基并放置在 37℃ 、 5%CO2 培养箱中培养。我们选择对数生长期的 4T1 细胞,使用含 EDTA 的胰蛋白酶进行细胞传代。
1.6 三阴性乳腺癌小鼠模型建立、实验分组及营养治疗方案
4~6 周龄 BALB/c 雌性小鼠与四川大学动物实验中心 SPF 级动物房进行随机分笼适应饲养 7 天。取对 数生长期的 乳腺癌细胞 4T1 , 使用 无 血 清 DMEM 培养基调整细胞浓度为 1×10 7 /100μl 左右,在小鼠的左侧背部皮下接种细胞悬液 200μl 。第 10 天,小鼠背部皮下可触及肿瘤,进行随机分组给药。选择肿瘤体积一致、 形态规则的 BALB/c 小鼠 24 只, 随机分为 4 组, 分别为:空白对照组( Control 组)、紫杉醇化疗组( Control+ 紫杉醇组)、添加酪蛋白的紫杉醇化疗组(酪蛋白 + 紫杉醇组)、添加活性乳清蛋白的紫杉醇化疗组( ABD+ 紫杉醇组)。第二天进行给药, Control 组小鼠进行腹腔注射氯化钠注射液 200μl 和饮用灭菌水,其余组小鼠使用紫杉醇溶液,每次按照 5mg/kg 进行腹腔注射给药 200μl 。酪蛋白粉和 ABD 活性因子分别加入灭菌饮用水中,浓度为 120mg/ml ,每日换水一次,根据既往试验和文献,小鼠一天的饮水量 5ml 左右, 保证每只小鼠的蛋白摄
入量在 600mg 左右。每 2~3 天使用游标卡尺测量一次肿瘤的长短径和称量一次小鼠重量直至出现第一只小鼠死亡停止记录,肿瘤体积 =0.5× 长径 × 短径 [ 2 ] ,记录小鼠的生存时间。另有一批相同处理条件的小鼠,给药 21 天后处死小鼠,取血测量 GSH 含量。解剖取下肿瘤、称量并进行拍照记录。解剖下肺放置于多聚甲醛溶液中拍照记录转移瘤数目。
1.7 GSH 含量测定
解剖取下小鼠肿瘤组织, 用液氮速冻后研成粉末,加入去除试剂 S 溶液,充分匀浆, 4℃ 放置 10min 后, 10 000g 4℃ 离心 10min ,取上清用于总谷胱甘肽的测定。小鼠眼眶取血所得新鲜血液 600g 离心 10min ,取上清血浆加入去除试剂 S 溶液混匀,冰浴放置 10min 。4℃ , 10 000g 离心 10min 。取上清用于总谷胱甘肽的测定。上述所得样品依次加入 96 孔板, 加入 150μl 总谷胱甘肽检测工作液, 混匀, 室温孵育 5min 后加入 50μl 0.5mg/ml NADPH 溶液,混匀,反应 25min 后使用酶标仪测定 A410 吸光度。根据不同浓度标准品测得的不同吸光度作出标准曲线。样品对照标准曲线即可计算出总谷胱甘肽的含量。
1.8 统计学处理
实验数据采用 SPSS19.0 统计软件进行分析。统计结果采用均数 ± 标准差( x± s )表示,比较组间差异采用单因素分析,组间两两比较使用 t 检验, P <0.05 为差异具有统计学意义。
2
结果
2.1 小鼠体重的改变
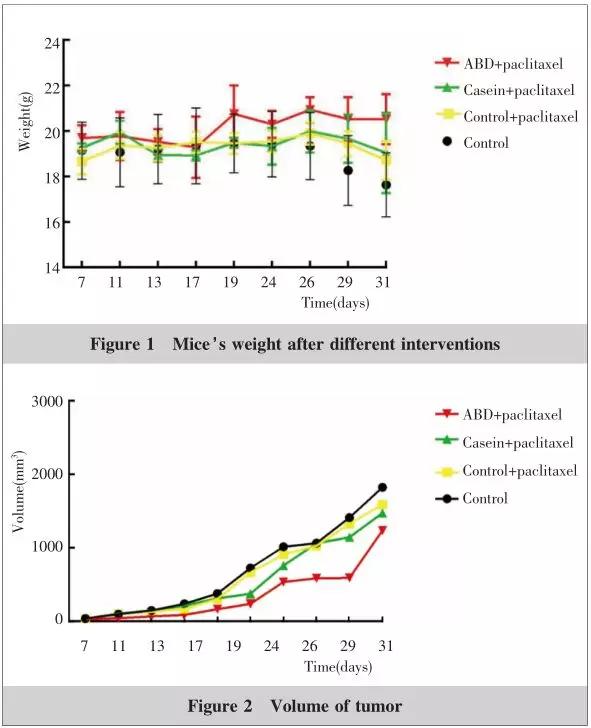
从第 26 天开始荷瘤小鼠体重出现明显下降,其中 Control 组下降速度最快,而 ABD 组体重下降速度明显缓于酪蛋白 + 紫杉醇组和 Control+ 紫杉醇组, 至第 31 天 Control 组瘤鼠体重[( 17.63±1.40 ) g ]低于 Control+ 紫杉醇组[( 18.71±0.86 ) g ],但差异无统计学意义( P =0.196 )。此时 ABD+ 紫杉醇组瘤鼠体重[( 20.52±1.10 ) g ]显著高于酪蛋白 + 紫杉醇组[( 19.03±1.76 ) g ]( P =0.006 )和 Control+ 紫杉醇组( P =0.003 )( Figure 1 )。
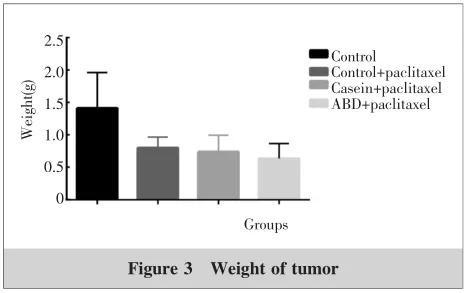
2.2 瘤体积及实验终点瘤体重量的改变
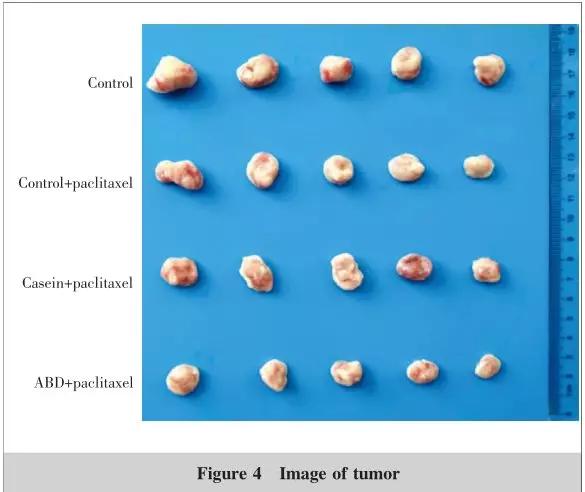
小鼠皮下接瘤成功后 4T1 肿瘤的体积在第 24 天出现相对平缓增长, 而后呈现逐步上升趋势,ABD + 紫杉醇组较酪蛋白 + 紫杉醇组和 Control + 紫杉醇组肿瘤体积相对平缓增长时间明显增加。3 周后处死小鼠,测量小鼠肿瘤的体积及重量。实验终点各组肿瘤重量分别为:ABD+ 紫杉醇组( 0.64±0.23 ) g 、酪蛋白 + 紫杉醇组( 0.74±0.26 ) g 、 Control+ 紫杉醇组肿瘤( 0.80±0.17 ) g 、 Control 组( 1.41±0.55 ) g(Figure 2~4) 。
2.3 肺转移瘤数量
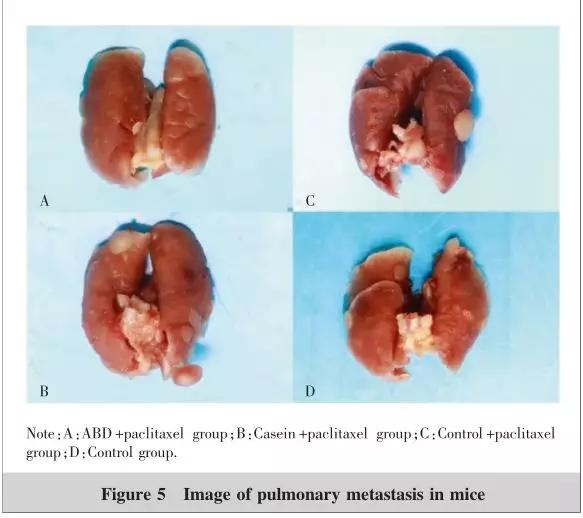
试验小鼠进行试验 3 周后解剖小鼠的肺组织。观察各组小鼠肺转移情况并计数肺表面的瘤结节数(Figure 5) 。其中 Control 组平均转移数为 8.8 个,Control+ 紫杉醇组为 4.2 个,酪蛋白 + 紫杉醇组为 4.8个, ABD+ 紫杉醇组为 4.0 个。Control 组与 Control + 紫杉醇组对比差异具有统计学意义 ( P =0.015) ;Control 组与酪蛋白 + 紫杉醇组差异具有统计学意义 ( P =0.038) , Control 组与 ABD + 紫杉醇组差异具有统计学意义 ( P =0.016) 。但是酪蛋白 + 紫杉醇组与 ABD+ 紫杉醇组对比差异无统计学意义 ( P =0.524) 。
2.4 小鼠生存曲线
进行试验干预后, 记录各组小鼠的生存时间(Figure 6) 。实验开始第 33 天 Control 组开始出现死亡。第 34 天 Control+ 紫杉醇组与酪蛋白 + 紫杉醇组分别出现死亡小鼠, 而本实验的 ABD,+ 紫杉醇组直至第 39 天才出现死亡。试验进行第 50 天 4 组小鼠全部死亡。利用统计学分析 ( Log-rank test ),ABD+ 紫杉醇组的生存期较 Control+ 紫杉醇组 ( P =0.035) 与酪蛋白 + 紫杉醇组 ( P = 0.041) 延长存在统计学差异。
2.5 GSH 的改变
在试验 3 周后, 我们分别取小鼠肿瘤和血液进行谷氨酰胺( GSH )的测量。肿瘤组织中, ABD+ 紫杉醇组肿瘤的 GSH 含量 [ ( 34.5±18.0 ) μmol/L] 低于酪蛋白 + 紫杉醇组 [ ( 55.3±23.8 ) μmol/L] ( P =0.159 ) 和 Control+ 紫 杉 醇 组 [ ( 54.9±11.7 ) μmol/L]( P =0.067 )。血 液 中 , Control 组血 液 的GSH 含量 [ ( 14.3±8.2 ) μmol/L] 与 Control+紫杉醇组 [ ( 15.2±9.7 ) μmol/L] 无统计学差异( P =0.876 ),此时 ABD+ 紫杉醇组血液的 GSH 含量 [ ( 19.1±0.7 ) μmol/L] 高于酪蛋白 + 紫杉醇组 [ ( 13.0±8.8 ) μmol/L] ( P =0.158 )和 Control+ 紫杉醇组 [ ( 15.2±9.7 ) μmol/L ) ]( P =0.393 )。但是检验分析结果显示,三组小鼠无论肿瘤还是血液 GSH 含量均无统计学意义( Figure 7 、 8 )。
3
讨论
恶性肿瘤是一种消耗性疾病, 癌症患者体重减轻和营养不良的发生率为 31%~87% 不等 [ 12 ] 。此外,营养不良还与肿瘤的治疗手段有关。化疗作为肿瘤治疗的一种重要手段, 最常见的毒副反应是恶心呕吐 [ 13 ] 。许多患者自诉化疗期间口服食物摄入量明显减少。长期的营养不良状态与患者预后不良息息相关—— —降低生活质量 [ 14 , 15 ] 、增加治疗毒性 [ 16 ] 、减少生存率 [ 15 ] 、导致肿瘤局部复发增加 [ 17 ] 。营养不良导致患者平均住院日增加,整体治疗费用增加,经济负担加重。然而,在实际临床实践中,患者却很少接受饮食建议,临床营养治疗的比例亦较低。因此,对于接受化疗的肿瘤患者, 尤其是对于需要接受化疗的三阴乳腺癌患者,了解患者的营养状况 [ 18 ] ,尽早开始合理的营养干预有利于提高患者的治疗耐受性和依从性、 控制
不良反应,提升生活质量,改善临床预后。
GSH 是谷胱甘肽 S- 转移酶结合的重要抗氧化剂和辅助因子,是活性氧( reactive oxygen species , ROS )的主要清除剂,参与细胞的氧化还原调节 [ 19 , 20 ] 。在抗氧化防御和细胞凋亡调节中起着重要的作用 [ 21 ] 。而氧化还原调节已被证实是恶性细胞存活的重要组成部分 [ 22 ] 。促进细胞氧化还原平衡有利于增加细胞内活性氧和消耗保护性还原代谢物—— — GSH , 导致氧化应激并诱导细胞凋亡从而治疗癌症。消耗会加剧氧化损伤并且其补充可以防止氧化损伤。除了氧化还原调节, GSH 还可以参与调节致癌机制、 生长增殖、免疫调节、药物解毒 [ 23 ] 。乳清蛋白是一种富含支链氨基酸、功能性肽、抗氧化剂和免疫球蛋白的功能蛋白,占总乳蛋白的 20% ,成分接近母乳,易于消
化吸收,是临床营养干预的最好来源,被称为“蛋白之王” [ 24 ] 。由于它具有高营养品质和快速吸收的特点,乳清蛋白的营养价值被认为高于鸡蛋、酪蛋白和大豆蛋白 [ 25 ] 。由此产生的乳清蛋白各种衍生物(浓缩物,分离物和水解产物)也具有广泛的生理学特性,包括抗炎、抗氧化、抗癌、免疫调节、降低心血管风险等 [ 10 , 26 ] 。活性乳清蛋白( ABD 活性因子)是乳清蛋白的分离物,从新鲜牛乳中通过低温萃取而出,蛋白含量远高于普通乳清蛋白,可达 90% 以上的高生物活性的功能蛋白。
本实验就是探究活性乳清蛋白对化疗期间小鼠营养状态,以及治疗预后的影响。通过实验,我们可以得出活性乳清蛋白联合化疗对于控制远处转移较单纯化疗无明显差异,但是,活性乳清蛋白联合化疗可以减缓小鼠体重下降,改善营养状态,抑制肿瘤体积增长,提高小鼠的生存期。同时活性乳清蛋白可以增加血液中 GSH 含量。通常认为氧自由基的产生是癌发生中的关键步骤。除外肿瘤本身,化疗也会产生大量氧自由基,对机体造成过氧化损伤 [ 27 ] 。有报道提示乳清蛋白的膳食补充剂促进合成 GSH 对氧自由基的抑制以及对物质解毒作用可能致使它在一些泌尿生殖系统癌症中的具有抗肿瘤作用 [ 28 ] 。此外,细胞减少 GSH 消耗可以消除多药耐药相关蛋白 MRP1 介导的对长春花生物碱和蒽环霉素的抗性, 从而使化疗药物更容易到达 GSH 耗尽的细胞[ 29 ] ,使 GSH 与化疗药联合表现出协同抗肿瘤作用。GSH 还可以具有保肝、改善皮肤损伤效果和保护神经作用 [ 30 ] 。已经有动物模型证实 GSH 合成有利于调节氧化损伤和缓解药物诱导的肝毒性 [ 31 ] 。GSH 改善化学试剂所引起的皮肤损伤 [ 32 ] 和化疗引起的神经毒性 [ 33 ] 。
GSH 的这些生物特性可能是本实验中活性乳清蛋白提高小鼠生存期的重要原因。乳清蛋白增加体内 GSH 水平 [ 34 ] ,改善接受化疗期间患者的营养状况和免疫力 [ 35 ] ,达到抗肿瘤的效果。实验中我们可以观察到肿瘤组织中 GSH 含量降低。虽然差异无统计学意义,但是活性乳清蛋白组小鼠肿瘤的 GSH 含量低于空白对照组和添加酪蛋白的紫杉醇化疗组。GSH 在细胞内合成主要包括两个步骤:第一,谷氨酰半胱氨酸合成;第二,谷胱甘肽合成,而 GSH 水平又受到自身所合成浓度的负反馈调节。活性乳清蛋白通过将细胞内半胱氨酸转化为谷胱甘肽, 增加细胞内的 GSH 含量。由于增殖的需要, 肿瘤细胞中 GSH 的起始浓度较正常细胞明显增高,对于 GSH 的需求量和消耗也明显高于正常组织。导致肿瘤细胞对于 GSH 的消耗极为敏感。当乳清蛋白选择性地增加肿瘤 GSH 水平后,肿瘤组织迅速达到负反馈抑制点加之肿瘤细胞的极具消耗,导致 GSH 含量降低,诱导肿瘤细胞凋亡。这与我们实验发现的相一致,活性乳清蛋白小鼠的血液中 GSH 含量增加,肿瘤组织的 GSH 含量降低。
综上, ABD 活性乳清蛋白能够改善化疗期间的营养状况,促进生成谷胱甘肽,达到抗氧化的作用。同时提高化疗耐受性, 提高生活质量, 延长生存时间,是临床肿瘤患者进行营养治疗的不错选择。

 加入我们
加入我们
 联系我们
联系我们
 在线商城
在线商城





 全国统一服务热线
全国统一服务热线

 了解更多信息,请扫一扫加关注
了解更多信息,请扫一扫加关注 在线咨询
在线咨询 免费咨询热线
免费咨询热线 在线咨询
在线咨询