作者
Luc Montagnier
法国巴黎巴斯德研究所国家科学研究中心
Rene Olivier
法国巴黎巴斯德研究所
Catherine Pasquier
法国巴黎第七大学(Xavier-Bichat系国家科学研究中心)
本文节选自2008年诺贝尔医学奖获得者卢克·蒙塔尼教授主编的《癌症、艾滋病及神经退行性病变中的氧化应激》一书,他也曾在第十届艾滋病大会的开场演讲中,向全世界介绍并推荐ABD活性因子。 卢克·蒙塔尼教授在其著作中这样写到:“谷胱甘肽是细胞抗氧化机制的关键,而ABD活性因子作为半胱氨酸输送系统可有效促进内源性谷胱甘肽的合成...” 营养免疫调节及其与谷胱甘肽合成的关系 新鲜的原料牛奶包含了在牛奶乳清中可溶的蛋白,如果从天然牛奶中小心提取,这些蛋白可保持最初的结构和活性。 在1981年发现,正常的小鼠喂食牛奶乳清蛋白浓缩物(在特殊的温和非变性条件下制备)后,显著增加了对T辅助细胞依赖抗原的体液免疫反应,接下来大量的实验证实了这种现象。在这些发现的基础上,12年后一种被称为ABD活性因子的天然乳清蛋白(HNMPI)被加拿大魁北克省蒙特利尔的Immuotec公司研发出来。 具有生物活性的HNMPI喂食动物后,脾脏淋巴细胞中的谷胱甘肽(GSH)的含量更高,而在免疫反应中,充足的GSH水平是淋巴细胞增殖所必须的。对健康的老龄小鼠喂食HNMPI一段时间后,可发现肝脏和心脏中的GSH水平温和且持续的升高。此外,与对照的喂食等营养价值的食物相比,喂食HNMPI显著增加这些小鼠的平均寿命。 在Meister称作“GSH抗氧化系统”的细胞抗氧化活性中,谷胱甘肽起重要作用,因为谷胱甘肽直接参与中和活性氧,并维持具有抗氧化功能的维生素C和维生素E的还原态。

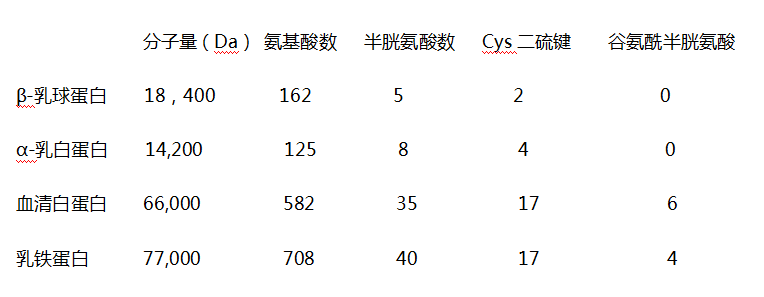
HNMPI 作为半胱氨酸运输系统的功能 使ABD活性因子成为有效的半胱氨酸运输系统的有效成分是什么?人口服的GSH能被机体利用的可以忽略不计,没有证据表明这些GSH能转运到细胞,因此,GSH只有在细胞内合成。这包括两个步骤:a.谷氨酰半胱氨酸合成;b谷胱甘肽合成;尽管在GSH的合成中,在特定环境下谷氨酸、半胱氨酸和甘氨酸的摄入有点受限,但大量的观察发现半胱氨酸(或胱氨酸,通常很快被降解成半胱氨酸)的转运在GSH的合成中是来源不足的,而且游离的半胱氨酸具有毒性且易被氧化,所以并不是理想的运输形式。在胃肠道中以胱氨酸形式存在的半胱氨酸二硫化物比游离半胱氨酸更稳定。GSH的合成受终产物GSH负反馈抑制。二硫键可耐受胃蛋白酶和胰蛋白酶的水解,但不耐受加热和机械力破坏。血浆中90%的半胱氨酸以胱氨酸的形式存在,而游离的半胱氨酸浓度极低。 在一项对比研究中,我们发现市售的牛奶乳清浓缩物相对于HNMPI,生物活性很低,促GSH合成能力低,乳清白蛋白的含量减半,乳铁蛋白的数量只有四分之一。ABD活性因子用一种温和的专利技术生产HNMPI,使绝大多数热不稳定蛋白都保留了其天然构象。 血清白蛋白分子量为66KDa,含17个半胱氨酸残基,6个谷氨酰半胱氨酸二肽。乳铁蛋白分子量77KDa,含17个半胱氨酸残基和4个谷氨酰半胱氨酸二肽,乳白蛋白分子量14KDa,含4个半胱氨酸。 另一方面,β-乳球蛋白分子量为18.4KDa,只有2个半胱氨酸。牛乳清中主要的免疫球蛋白IgG分子量为166KDa,只有4个二硫键。此外,Meister和他的团队发现GSH的前体γ-谷氨酰半胱氨酸(Glu-Cys)能轻易的进入细胞被合成GSH。因此价值最高的牛奶蛋白是含有促GSH合成多肽的血清白蛋白和乳铁蛋白。 最后,这些促GSH合成的成分,其生物活性(半胱氨酸和谷氨酰半胱氨酸基团)可能在消化吸收的过程中受其他蛋白成分的影响。 新发明的HNMPI除了和其他类似的蛋白具有同样的营养功能以外,还有其他的特定功能,这些功能由近期的体外实验进一步证实。 饮食中来源的半胱氨酸与免疫系统特异相关。在T细胞介导的免疫反应中,巨噬细胞的半胱氨酸摄入量和随后将降解的半胱氨酸释放到周边供淋巴细胞摄取的过程,一定程度上调控着巨噬细胞和淋巴细胞的协同反应。当抗原呈递巨噬细胞与抗原特异T细胞紧密接触,巨噬细胞能给这些细胞一定量的半胱氨酸使其胞内GSH水平升高。 ABD活性因子的这种免疫增强和促GSH合成的功能假设可被丁硫氨酸砜基亚胺所证实。丁硫氨酸砜基亚胺能抑制催化GSH合成起始步骤的中γ-谷氨酰半胱氨酸合成酶。
ABD活性因子对细胞内谷胱甘肽含量的体外调节 我们发现正常的人淋巴细胞用100ug/ml的HNMPI培养3天后,其细胞内的GSH含量从4.5±0.4上升到10.5±3.4nmol/106细胞。GSH的增加与用胸苷掺入法检测到的细胞增殖有关。 ABD活性因子对MT-4细胞的细胞致病因素的保护效应: 3个+表示存在细胞致病效应,-表示不存在 ABD活性因子促GSH的增加呈剂量依赖效应,但酪蛋白和其他市售乳清蛋白浓缩物没有这种功能。

 加入我们
加入我们
 联系我们
联系我们
 在线商城
在线商城




 全国统一服务热线
全国统一服务热线

 了解更多信息,请扫一扫加关注
了解更多信息,请扫一扫加关注 在线咨询
在线咨询 免费咨询热线
免费咨询热线 在线咨询
在线咨询